Our review on kinase activity analysis has received enough downloads to rank within the top 10% of papers published in the journal of Mass Spectronomy See Connie’s post.
Read More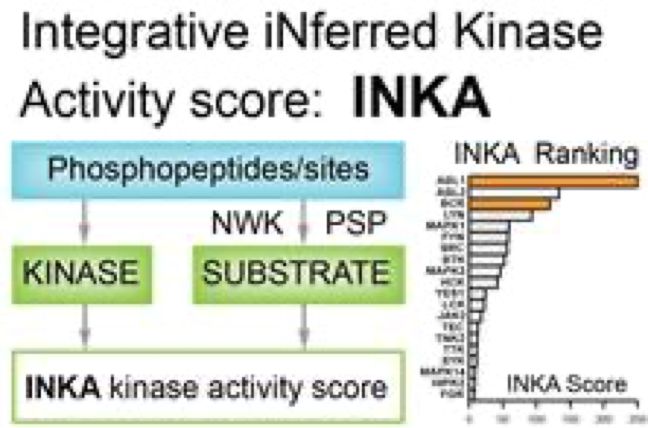
Top Downloaded Article
- March 28, 2024
- Comments off

Our review on kinase activity analysis has received enough downloads to rank within the top 10% of papers published in the journal of Mass Spectronomy See Connie’s post.
Read More
Last Friday Feb 16 it was our turn to present our work in the Cancer Center Amsterdam seminar series. We discussed our progress in: 1. Phosphoproteomics for individualized precision medicine; 2. Urinary vesicle proteomics for non-invasive prostate cancer diagnosis /prognosis; 3. Identification of protein biomarkers for cisplatin response prediction of response in non-small cell lung […]
Read More
Madalena presented her work on vesicle proteomics in colorectal cancer at the annual symposium of the Netherlands Proteomics Platform on Jan 19 2024. About the NPP
Read More
PhD students and master students were educated in all aspects of proteomics in the 14th edition of the 2-week elective master course “Biomedical Proteomics” that runs every year in the first 2 weeks of February. See here for this years schedule https://oncoproteomics.nl/education/
Read More
Our review entitled ” High-dose intravenous vitamin C, a promising multi-targeting agent in the treatment of cancer” (Bottger et al., J Exp Clin Cancer Res. 2021 Oct 30;40(1):343) is getting attention. Not only in PubMed but now also via a Podcast in the series Decoding Health Care Research. Watch on youtube: https://youtu.be/eDUWWOkY4S0?si=8O8Ffxrw8PEdnXW6
Read More
Celebration of next generation mass spectrometry in the Proteomics Core Facility Venue: Auditorium O2 building Date: 14.00- 17.30, 23 Jan. 2023 Program 14.00- 14.15 Inloop (koffie / thee) 14.15-14.20 Welcome (Connie Jimenez, director Proteomics Core Resource) 14.20-14.30 (Phospho)proteomics highlights of the past decade (Connie) Collaborator orals 14.30-14.45 Proteomics to study […]
Read More
Core question: Can we identify predictive protein biomarkers for the selection of patients benefiting from platinum-based adjuvant chemotherapy (ACT) in non-small cell lung cancer (NSCLC)? Core insight: Our study published Nov 27th in Molecular Oncology presents the discovery of predictive biomarkers that can aid in distinguishing patients with NSCLC likely to derive clinical benefit from […]
Read More
In our recent study pubished in Cell Reports, PhD student Andrea Valles shows how profile-guided phosphoproteomics can be used to select low dose combination treatment based on three kinase inhibitors. Kinase activity ranking of individual cell lines using our INKA pipeline, provided the rationale for a combination of within pathway and parallel pathway targeting with triple […]
Read More
Connie Jimenez, The Netherlands What is your current position and location? I am full Professor of Translational OncoProteomics, Principle Investigator of the OncoProteomics Laboratory and Director of the Proteomics Core Resource, all at Amsterdam University Medical Center, in the beautiful city Amsterdam where I was born, in The Netherlands. How did you get started […]
Read More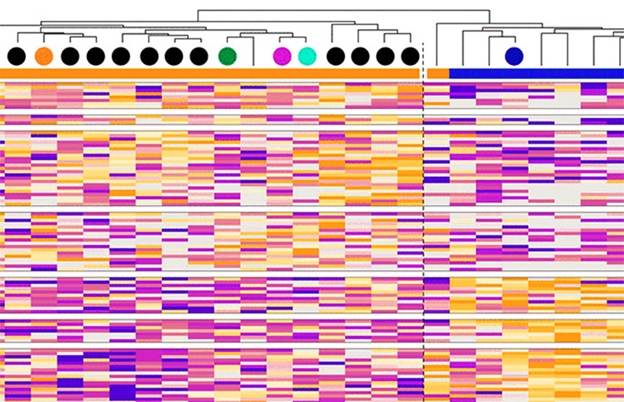
Can mass spectrometry-based phosphoproteomics help understand the (lack of) response to EGFR-blockade and identify predictive markers and new treatment options? We analyzed a unique collection of 29 molecularly characterized colorectal patient-derived xenograft (PDX) tumors, annotated for cetuximab response. Proteomics identified CXADR as promising marker of treatment response, while phosphoproteomics coupled to single sample kinase activity […]
Read More